一、生物医药产业创新链
生物医药是以研发创新为核心的知识密集型产业,创新链可分为基础研究、临床前研究、临床试验、制造销售等环节,药物与器械间、不同药物/器械间创新过程有所区别。在创新各环节过程中,药监、科技等相关部门的审批监管是完成生物医药产业各个创新环节的重要节点,全流程审批监督也属于创新链重要内容。因此,生物医药产业创新链包括基础研究、临床前研究、临床试验、产业化、全流程审批监督。具体参见图1。

图 1 生物医药创新流程
(一)基础研究
基础研究的目的是确定进入临床前试验的候选药物,这一过程具体可分为靶标确定、模型建立、先导物发现、先导物优化4个阶段。针对治疗疾病及疾病相关靶点,利用多种途径获取相关物质,并通过计算机药物分子设计、蛋白质水平检测等方法,建立药物模型以及筛选、评价药物,找出具有药理特性显著的先导物。在发现先导物后,经过蛋白质改造、组合化学等方式处理,优化先导物的治疗指数,形成结构类型新颖、药效最佳的物质作为候选药物。
(二)临床前研究
临床前研究指通过实验室研究和动物实验系统对候选药物进行评价、分析研究及提纯研究,通过对药物的药理、毒理、药剂等研究,确定是否符合进入人体临床试验的条件。药理研究探究药物与机体间相互作用规律及药物作用机制,包括药效动力和药代动力。毒理研究是研究药物对生物体的毒性反应、严重程度、发生频率和毒性作用机制,并对毒性作用进行定性和定量评价。药剂研究指将药物制成适宜的剂型及剂量。临床前研究是药物获得临床资格的必要前提,以自主研发、技术联盟、转让许可、技术服务为主。
(三)临床试验
临床试验在人体进行药物的系统性研究,目的是确定试验药物的疗效与安全性,证实或揭示试验药物的作用、不良反应等。通过临床前研究的药物需要经过新药临床试验申请才能进入临床试验。临床试验一般分为I、II、III、IV期临床试验和EAP临床试验,完成I、II、III期临床试验后,可向药监部门提出新药上市申请,获得注册上市批件即完成临床试验。临床试验一般由科研院所、临床实验医院/基地、合同研究机构、医院和患者等共同完成。
(四)产业化
产业化主要包括生产制造和销售2个环节。生产造环节以获批药品注册证/医疗器械注册证为起点,将药物发现和开发环节得到的创新成果依据市场需要进行加工,转化为患者可以直接使用的最终药品。医疗器械制造涉及产业链较长,需要材料、机械、电子元器件等基础性行业作为支撑。销售环节是价值链上的最后一个环节,生物医药产品销售方式不同于其他商品,部分药品器械的购买需凭医生处方。同时,药品器械的医保采购、政府集中采购与普通商品的政府采购有所区别。
(五)全流程审批监督
审批监督贯穿生物医药产业各个创新环节。其中,生物医学研究伦理审查、人类遗传资源审批是开展生物医药产业基础研究、临床前研究、临床试验重点审批监管的内容,生物医学研究伦理审查在我国由卫健部门负责,对涉及人的生物医学研究均需要按照相关管理规定开展相关工作;人类遗传资源管理在我国由科技部门负责。除一类、二类医疗器械除外,药品器械开展临床试验前需要获得临床试验批件;对药品器械上市前需获得注册上市证书。生产制造方面,同样需要药监部门审批监督。

表1 药物器械全流程审批监督情况
二、生物医药产业创新特点
(一)具有“四高一长”的创新发展特性
即高投入、高技术、高收益、高风险、长周期。其中,高投入表现在资金、人才、设备等方面的高投入。高技术表现在研究人员的高素质、产品高标准以及生产环境与设备的高要求。高收益表现为生物药品高附加值特性能够带来高额利润。虽然药品器械需要大量研发资金,但成功研发的产品将在保护周期内处于垄断地位,企业很快能收回成本并具有较大利润空间。高风险表现为新药研发本身面临失败的风险,主要源于药品复杂的研发流程及较长开发周期,新产品研发成功率较低,生物技术药开发的成功率约为5%~10%。长周期即需要很长的开发时间,国内新药开发时间最快也需3~5年,国外一般需要8~10年,甚至更久。
(二)不同类别生物医药产品创新链各异
生物技术药与化学药创新流程大体相似,基础研究环节的主要任务均为靶标确定、模型建立、先导物发现与优化;临床前研究、临床试验流程、研究内容及审批监管机制大体一致,需完成后才能申请注册上市。中医药发源于我国,自20世纪西医传入我国后,中医药借鉴了西医的研究思路方法开展了大量研究,但对中药理论本身的研究逐渐减少,从指导思想到具体研究方法、评价标准,中药理论体系建设不完整。因此,目前中药临床前研究、临床试验评价标准有欠缺,学科理论及标准化建设正加速推进,部分以院内制剂、经典名方形式出现。医疗器械属于多学科融合领域,虽然医疗器械创新流程与药品大体相当,但也有所区别,其中,一类医疗器械产品注册审批备案即可,不需进行临床试验。
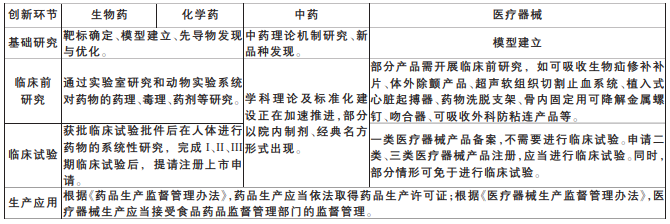
表2 药物器械创新流程
(三)产业集聚创新发展特征明显
生物医药产业研发周期长、投入高、风险大等特点致使单个企业难单独完成研发全过程,对集群环境的依赖性成为生物医药产业创新的重要特征。生物医药产业对知识的依赖性很强,大学、科研机构、企业以及相关医疗机构在空间集聚,能够有效推动知识在集聚区域的流通,大学科研机构开展基础研究推动知识外溢,企业获取最新知识推动技术创新,集聚发展也有利于不同主体开展协同合作、降低研发风险。美国波士顿、旧金山、圣地亚哥、华盛顿—巴尔的摩、北卡三角研究地带等5大生物医药产业集聚区是产业集群发展的直观表现。企业、人才的高度集聚推动“丹麦—瑞典”生物谷的成功建设。
(四)具有应对突发疾病科研攻关至关重要的支撑作用
历史证明,重大公共卫生事件防御和应对离不开科学技术的支撑。新冠肺炎疫情发生以来,党中央提出了临床救治和药物等五大主攻方向。要完成这五大主攻任务,必须要有生物医药产业创新体系作为支撑。生物医药产业创新体系在国家创新体系和治理体系中具有重要地位。新冠肺炎疫情使我们更加深刻认识到,构建重大疾病防控科研攻关体系,加强应急科研攻关能力建设,要与促进生物医药产业技术研发、企业创新、高层次人才、创新平台建设、临床审批监管机制优化等方面的创新发展紧密结合,构建支撑科研攻关的生物医药创新体系。
(五)重视生物安全及科研伦理
恪守科研伦理是科研工作者重要的社会责任。近年来,国家越来越重视生物医学研究创新发展伦理建设能力提高,着力推动医学科研工作的规范、有序开展,加强保护受试者权益的保护和人民生命的健康,促进科研创新的同时重视风险管理。2020年10月,我国通过了《中华人民共和国生物安全法》,以法定形式提出对生物伦理审查及人类遗传资源监督管理的相关要求。与此同时,北京、上海、广东等多地出台相关政策,提出要加强生物医学研究伦理建设。(作者:胡海鹏 袁永)
